 I. ¿QUÉ SON LAS CARGAS?
I. ¿QUÉ SON LAS CARGAS?

N ESTE capítulo vamos a recopilar el conjunto de
propiedades fundamentales de las cargas eléctricas. En su mayoría pueden
ser conocidas de muchos lectores porque los fenómenos electromagnéticos
tienen una historia venerable. Me gustaría recordar aquí los aspectos
más interesantes del electromagnetismo. Para todos será agradable
imaginar los grandes esfuerzos realizados por miles de pensadores con el
solo objeto de descubrir y organizar las diferentes ideas sobre estos
temas. Al recordar la formación, lenta, de estos conceptos nos
maravillamos de la estructura tan elegante y simple con la cual hoy
podemos entender tantas propiedades que en el pasado estaban disconexas y
sin relación evidente. El mundo parecía el reino de la confusión, cuya
única explicación era el caos. Mediante la labor continua y paciente de
muchos científicos curiosos, de muchas mentes ingeniosas en busca de lo
nuevo y de lo útil, se fueron descubriendo propiedades y aplicaciones,
se encontraron relaciones y analogías. Se hicieron síntesis y
generalizaciones.
Las cargas eléctricas son partículas que ejercen fuerzas atractivas y repulsivas entre ellas. Por ser partículas, tienen una masa que se opone a ser acelerada por fuerza alguna, y sufre la atracción gravitacional del centro de la Tierra, como todos los demás cuerpos sobre la superficie del mundo.
Se dividen en dos tipos diferentes: las cargas positivas y las cargas negativas. Una positiva y una negativa se atraen entre sí. Si se atraen, deben ser de distinta carga.
Las cargas negativas repelen a las cargas negativas. Las cargas positivas también se repelen entre sí.
Si encontramos una carga desconocida, para preguntarle su tipo de carga le acercamos una carga positiva. Si se aleja la carga desconocida de la carga positiva es porque se trata de una carga positiva; si la carga —antes desconocida— es atraída por la carga positiva sabremos en ese momento que es negativa.
Si una partícula no se aleja ni se acerca de una carga positiva, entonces no es una carga sino una partícula neutra.
Estoy suponiendo aquí que para alejarse o acercarse estas partículas están en libertad de moverse, no están sujetas por otra fuerza eléctrica o de otro tipo.
La fuerza eléctrica entre cargas se llama fuerza de Coulomb; es directamente proporcional a las cargas e inversamente proporcional al cuadrado de la distancia entre las cargas. Es decir, al aumentar una carga, 2, 3, 4, etc., veces en el mismo lugar, la fuerza aumenta 2, 3, 4, etc., veces. Al incrementar la distancia entre las cargas 2, 3, 4, etc. veces, la fuerza disminuye de tamaño a 1/4, 1/9, 1/16, etc. de su tamaño original, porque 4 es el cuadrado de 2, 9 es el cuadrado de 3, 16 es el cuadrado de 4, y así sucesivamente. Con ayuda de símbolos, si F representa la fuerza, q la carga, R la distancia y una A constante, entonces la relación entre la fuerza, la carga y la distancia, se representa por la ecuación
La constante A es proporcional a la otra carga diferente de q.
Se le llama campo eléctrico a la fuerza por unidad de carga que se sentiría al colocar en un punto a una carga. En cualquier punto de la vecindad de una carga hay un campo. Ese campo se convierte en una fuerza hasta que colocamos una carga. Mientras no hay una carga el campo no produce fuerza. En ausencia de carga ese campo sólo puede ser observado cuando produce efectos luminosos, como más adelante veremos.
Si unimos varias cargas pueden formarse partículas neutras a condición de tomar la misma cantidad de carga positiva que de carga negativa. Las partículas neutras tienen una compensación casi total de la fuerza eléctrica positiva con la negativa. Digo casi total porque las dos cargas no están situadas en el mismo lugar y la pequeña diferencia de localizaciones produce un efecto medible llamado dipolar porque reconoce dos centros diferentes.
Sabemos ahora que todas las sustancias están formadas por cargas, pero generalmente esas sustancias las observamos en forma neutra con un equilibrio de carga positiva y negativa.
La partícula más pequeña de una sustancia es una molécula. Y también las moléculas de una sustancia son iguales entre sí. Hay millones de sustancias diferentes y todas tienen moléculas diferentes, pero estos millones de moléculas están formadas por un poco más de sólo cien tipos diferentes de átomos de los elementos químicos. Las combinaciones de átomos en proporciones diferentes son las que producen la gran variedad de moléculas.
Cada átomo está formado por un núcleo pesado de carga positiva el cual se halla rodeado por una nube ligera de cargas negativas, los electrones. Todos los electrones tienen la misma carga y el mismo peso, todos parecen iguales entre sí. El núcleo de carga positiva de este átomo está formado de protones y neutrones. Los protones son cargas positivas, y los neutrones —su nombre lo dice— son partículas neutras. En un átomo hay el mismo número de protones y de electrones, y entonces es neutro.
El protón tiene la misma cantidad de carga que el electrón pero positiva. Por otra parte, los protones y neutrones son mucho más pesados que los electrones —más de mil ochocientas veces—, pero los pesos de un protón y de un neutrón son casi iguales entre sí.
Se observa aquí una aparente falta de simetría en la naturaleza. Electrones y protones con la misma carga pero con masas tan diferentes. La simetría se recupera cuando encontramos los positrones, electrones positivos con igual masa que el electrón. Asimismo se encuentran los negatones, protones negativos con igual masa que el protón. Pero ni aun esto recupera del todo la simetría del mundo, puesto que los protones y electrones, con sus masas tan diferentes, son los que dominan por su gran número todas las sustancias observadas. Los positrones y negatones son excepciones del Universo que contemplamos.
En un átomo la carga total se anula o neutraliza porque el número de electrones es igual al de protones.
¿Por qué todos los electrones tienen la misma carga? ¿Por qué los protones tienen el mismo valor de carga, con distinto signo? No hay una respuesta fácil a estas preguntas; formulamos tan sólo el hecho sin pretender aquí una respuesta. Nótese que aunque en valor absoluto las cargas de electrón y protón sean iguales, sus masas sin embargo son muy diferentes, casi dos mil veces. Mucho más fácil es contestar a la pregunta ¿cómo sabemos que las cargas tienen todas el mismo valor? En respuesta a lo anterior resulta interesante recordar las dos experiencias de Millikan y Faraday. Veamos primero la de Millikan.
El experimento de Millikan permitió comprobar que la carga se da en paquetes enteros iguales a la carga del electrón. Hubo antes otros experimentos similares pero menos claros. En este experimento, sin embargo, con un microscopio cuyo tubo estaba colocado horizontalmente, se observó una pequeña gota de aceite en un conjunto de gotas esparcidas dentro de una cámara transparente. Las gotas se cargan eléctricamente al radiarlas con rayos X. La gota bajo observación cae con velocidad constante como resultado de la acción combinada de la gravedad y la fricción del aire. Posteriormente se aplica un campo eléctrico que obliga a las gotas a ascender con velocidad, también constante. De la medición de ambas velocidades es posible deducir el valor de la carga que porta la gota. Las observaciones de Millikan en muchas gotas permiten afirmar que no se encuentra carga menor a la carga del electrón. Además, todas las cargas medidas son un múltiplo de la carga del electrón.
Este resultado experimental es congruente con todas las demás mediciones llevadas a cabo hasta ahora, relacionadas con el valor de la carga. No existe evidencia experimental de que se haya medido una partícula con una carga que sea una fracción de la carga del electrón. Pero tampoco hay nada que prohiba su existencia. En el futuro es muy probable que pueda dividirse el electrón y sus constituyentes podrán tener valores fraccionarios de su carga. Tal división es hoy únicamente una especulación fuera de la verificación científica.
El experimento de Faraday permite también medir la carga del electrón y hablaremos de él más adelante, después de haber explicado la idea de isótopo.
Entre protones y neutrones se ejerce una fuerza aglutinante del núcleo que impide que los protones estallen y se repelan entre sí, como lo hacen todas las cargas positivas. Ésta es la enorme fuerza de unión nuclear que se percibe sólo a distancias muy pequeñas y supera más de cien veces a la fuerza eléctrica de Coulomb. Si con un enorme gasto de energía se separan dos porciones con carga positiva de un núcleo a una distancia dada, la fuerza nuclear deja de existir como unión de las dos cargas positivas y esos dos pedazos de núcleo se repelen con la fuerza eléctrica entre cargas positivas, pero ya no se siente la fuerza nuclear. En resumen, la fuerza nuclear es enorme a distancias muy pequeñas y se vuelve de poca intensidad cuando crece la distancia que separa a las cargas.
La desaparición de la fuerza nuclear en estas circunstancias tiene algún parecido con un sólido que se rompe en dos partes: ya no hay fuerza tan grande entre esas dos partes del sólido como había antes de romperse.
En el Universo hay otras partículas cargadas y neutras: positrones tan ligeros como los electrones con carga positiva, y negatones tan pesados como los protones y neutrones pero con carga negativa y muchas otras partículas más que serán descritas con mayor detalle en otros libros de esta serie. Muchas de estas partículas no son tan frecuentes o evidentes en nuestra discusión, por lo que tendremos que dejarlas de lado. Le damos la mayor importancia a electrones, protones y neutrones que constituyen casi la totalidad de las sustancias conocidas. Más adelante, forzados por la necesidad de considerar altas energías, el número de las partículas encontradas no tendrá límite.
Por lo pronto, quiero mencionar solamente a otras partículas llamadas mesones Pi, los cuales pueden ser positivos, negativos y neutros. Estos mesones aparecen en el núcleo como una especie de intermediarios en las transformaciones protón a protón, protón a neutrón, neutrón a protón y neutrón a neutrón, que ocurren en el núcleo —y fuera de él— y son responsables de la fortísima unión entre ellos, la fuerza nuclear capaz de ganarle a la fuerza eléctrica de Coulomb.
Las primeras cargas eléctricas se hicieron notar como una fuerza de atracción entre dos materiales que se frotaban. El frotamiento originaba que los electrones de un material pasaran al otro y, así, quedaban cargados ambos. Uno con carga positiva, por haber perdido electrones, el otro con carga negativa por haberse quedado con más electrones de los necesarios para que hubiera neutralidad.
Por ejemplo, cuando se frota resina con vidrio, la resina se carga positivamente y el vidrio negativamente. Todas las cargas que repele el vidrio frotado son cargas negativas. Todas las cargas atraídas por ese vidrio son positivas.
Todos los átomos, con el mismo número de electrones —o protones—, tienen las mismas propiedades químicas y forman la parte más pequeña de un elemento químico.
Vivimos siempre rodeados por cargas. Éstas se encuentran generalmente dentro de sustancias neutras formadas por átomos o por moléculas. Al no estar solitarias las cargas no notamos su fuerza eléctrica que mantiene en equilibrio todas las cargas a nuestro alrededor.
En nuestra casa las cargas eléctricas son familiares en forma de corriente de cargas que circula por conductores metálicos aislados por materiales no conductores llamados dieléctricos tales como los plásticos, el aire, el vidrio, la cerámica, etcétera.
Las cargas tienen gran dificultad en atravesar a los dieléctricos pero caminan libremente en los metales. Algunos electrones de cada átomo del metal, los cuales se dice que están en la banda de conducción, se mueven fácil y rápidamente de un átomo al vecino cuando son impulsados por la energía producida en las centrales eléctricas o en cualquier otra fuente a fin de transformar trabajo o energía química en energía electromagnética.
Al pasar por resistencias, la corriente de cargas eléctricas puede tostar el pan y permite cocinar, calienta la habitación y plancha la ropa. Si pasa por las lámparas, produce incandescencia de filamentos o tubos, e ilumina. Da la fuente de energía para amplificar las señales de radio y televisión. En nuestra computadora, ilumina la pantalla y pone en funcionamiento a la memoria y al procesador.
Una de las funciones interesantes que produce la corriente eléctrica es la posibilidad de generar movimiento mecánico, que utilizamos en los motores del taladro, la aspiradora, las lavadoras de ropa o de trastos de cocina, la licuadora, en el refrigerador, y en tantos otros mecanismos útiles. Este es uno de los grandes usos de la corriente, y es posible por la relación entre el magnetismo y la electricidad.
Todos estos aparatos con motores eléctricos funcionan por la inducción electromagnética. Las corrientes eléctricas en los embobinados de alambres crean campos magnéticos y los campos magnéticos producen movimientos entre embobinados que pueden utilizarse en las formas que arriba se mencionaron, las cuales son muy conocidas y que encuentran también muchas otras aplicaciones usadas en el automóvil y en el trabajo.
La factibilidad de convertir la energía eléctrica en trabajo mecánico y viceversa, la posibilidad de transformar el trabajo mecánico en energía eléctrica es uno de los grandes inventos en nuestros días. Se realiza por medio del dinamo inventado por el físico belga Gramme (1826-1901). Este invento se usa en las grandes centrales hidroeléctricas, donde el trabajo mecánico producido por una caída de agua mueve los enormes dinamos. En otras centrales puede usarse la energía geotérmica; el vapor a alta presión y temperatura se escapa de la tierra en las regiones volcánicas y este vapor puede mover turbinas y producir electricidad. Otras centrales usan motores Diesel o de gasolina. Recientemente se ha generalizado el uso de reactores nucleares los cuales se usan para transformar energía térmica en energía mecánica y ésta, en eléctrica.
Los reactores nucleares son menos conocidos, aunque son esencialmente una caldera que produce un fluido a temperatura muy alta y recibe el mismo fluido a una temperatura menor. El reactor eleva la temperatura del fluido. El calentamiento se produce mediante reacciones nucleares, las cuales serán posteriormente discutidas. La producción de reacciones nucleares está moderada a fin de producir únicamente la energía requerida y evitar la reacción en cadena, como ocurre en las bombas nucleares.
Veamos antes cuáles fueron los momentos culminantes de la historia del electromagnetismo.
RECORDANDO AL MAGNETISMO
Las propiedades magnéticas observadas en la Antigüedad se explican ahora con el ferromagnetismo, una propiedad de algunos materiales, observada primero en el hierro. Un material ferromagnético en presencia de un campo magnético sufre una fuerte magnetización que se explica porque cada átomo funciona como un pequeño imán que se alinea con el campo, y entre los átomos se establece un acoplamiento que viene a reforzar la tendencia al paralelismo con el campo externo, venciendo la propagación del desorden producido por el incremento de la temperatura. Los metales ferromagnéticos más importantes son el hierro, el cobalto, el níquel, el gadolinio y el disprosio. Aleaciones de éstos y otros metales muestran el mismo fenómeno.
Las primeras referencias escritas en torno al magnetismo en China tienen más de 2 000 años de antigüedad.
Según el barón Von Humboldt, en el Szuki de Szumthsian, libro chino que data de la primera mitad del siglo
II
de nuestra era, se menciona el carro magnético que el emperador
Tschingwang de la dinastía Tscheu, había dado 900 años antes a los
embajadores de Tunking y de la Cochinchina para que no pudieran
extraviarse al volver a su país. Y en el diccionario de Schuewen de
Hintschin del siglo III de nuestra era, está indicado el
procedimiento en cuya virtud se puede comunicar a una lámina de hierro,
por medio de un frotamiento regularizado, la propiedad de dirigir una de
sus puntas hacia el Sur. El Sur fue la dirección habitual de los
navegantes chinos, como lo fue el Norte para los navegantes europeos.
El descubrimiento más antiguo que se recuerda relacionado con las fuerzas magnéticas fue la brújula, realizado por los chinos. Éstos advirtieron la propiedad magnética de la Tierra al poder alinear a lo largo de los meridianos terrestres a una pequeña aguja imantada, pues la Tierra se comporta como un gran imán que atrae a otros imanes. La llamada aguja de marear se transmitió a la India y Arabia en el curso de los siglos. La aguja imantada se usó por los egipcios, durante la dominación romana, para orientar sus barcos en las travesías entre Ocelis y las costas de Malabar.
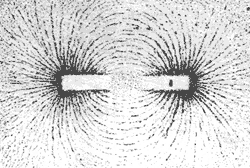
El mineral magnetita se encontró en la provincia griega de Magnesia en Tesalia. Existen escritos sobre las propiedades de este óxido de hierro desde 800 a.C. En el poema de Tito Lucrecio Caro De la naturaleza de las cosas, transcribo del libro
VI:
Por lo que resta, empezaré a decir por qué pacto
de natura ocurre que pueda el hierro atraer esta piedra que magneta
llaman por el patrio nombre los griegos porque fue en los fines patrios
de los magnesios surgida.
|
Según Del Río y Máximo, en las ruinas olmecas de San Lorenzo, Veracruz, encontraron R. Roster y M. D. Coe una barra magnética de 3.5 cm, estudiada posteriormente por J. B. Carlson en la Universidad de Michigan. Esta barra tiene una edad estimada en tres mil años.
Las primeras citas de la aguja imantada en Europa están quizá en la poesía de la "Brújula", en la Biblia satírica de Guyot de Provins (1190) y en la descripción de Palestina por el obispo de Tolemaida, Santiago de Vitry (1204-1215). Dante Alighieri, en el canto
XII del "Paraíso", menciona en una comparación a la aguja (ago) que se dirige hacia la estrella del polo. Dice Dante:
... de en medio de una de aquellas nueve luces
salió una voz que me atrajo hacia sí, como la estrella del polo atrae
a la aguja.
|
En 1269, Pierre de Mericourt, el Peregrino, en su libro De magnete publica el primer trabajo científico sobre las piedras imantadas. Conocía la existencia de los dos polos magnéticos, Norte y Sur, sabía que polos diferentes se atraen y polos iguales se repelen. Descubrió que si se parte un imán, cada pedazo adquiere dos polos, Norte y Sur, por lo cual no le era posible aislar a uno de ellos. Describió la inducción magnética en otros cuerpos metálicos. Diseñó y presentó en ese libro una máquina de movimiento continuo que aprovechaba la atracción entre los imanes para moverse, la cual por supuesto nunca fue construida. Construyó una esfera de piedra imantada y observó y dibujó las líneas del campo con el auxilio de una aguja metálica imantada.
La brújula se usó frecuentemente para la orientación de los barcos en el mar desde el siglo
XIII. Raimundo Lulio en sus dos obras: Libre de contemplación en Déu, de 1272, y Félix o libre de meravelles,
escrito en 1286, relata que los navegantes de su tiempo se servían de
instrumentos de medición, de cartas marinas y de la aguja imantada.
En el Panthsaoyan chino, compuesto bajo la dinastía Song (1111-1117), encontramos los primeros rastros del conocimiento de la declinación magnética occidental.

Se llama ángulo de declinación al que existe entre el meridiano geográfico y el meridiano magnético de un lugar. La declinación es oriental u occidental; oriental, si el polo austral de la aguja se desvía hacia el Este, y occidental si se desvía al Oeste. La declinación es oriental en Asia y en las dos Américas, y occidental en Europa y en África. La declinación se observa ya en el mapa de Andrés Bianco en 1432.
Cristóbal Colón descubre el 13 de septiembre de 1492 la línea sin declinación a dos grados y medio al Este de la isla Corvo. Ahí la declinación magnética cambia del Nordeste al Noroeste. Sebastián Cabot redescubre la línea sin declinación cinco años después.
En la Geografía de Tolomeo, publicada en Roma en 1508, se encuentra un mapa de América donde el polo magnético está situado en una isla volcánica, al norte de Groenlandia.
Alonzo de Santa Cruz, maestro de Carlos V, tomó mucho interés para determinar en sus viajes en barco la inclinación y declinación de la brújula. Acometió en 1550 la tarea de trazar el primer mapa general de las variaciones magnéticas de la Tierra, que se adelantaron en 150 años al trabajo de Edmond Halley (1656-1742) en Inglaterra.
El ángulo de inclinación magnética es aquel que, con la horizontal, indica la dirección del campo magnético de la Tierra. Se observa cuando se suspende la aguja magnética de un eje horizontal, de preferencia perpendicular al meridiano magnético. La aguja se mantiene horizontal en el Ecuador y conforme se dirige uno hacia el Norte, la aguja se inclina del lado de su polo austral hasta alcanzar la inclinación vertical en el polo Norte magnético. En el hemisferio Sur es el polo Norte el que se inclina.
Francisco Faleiro, un portugués al servicio de la Armada Española publicó en 1537 un Manual de astronomía y ciencia náutica donde anuncia un método práctico para determinar la declinación magnética, y había antes escrito en 1535 otro tratado que se conserva en la Biblioteca Nacional de Madrid, Tratado del esphera y del arte del marear; con algunas reglas nuevamente escritas muy necesarias.

Jõao de Castro, portugués, fue a la India con 11 barcos en 1538, y determinó en su viaje la declinación y las tormentas magnéticas, la desviación de la brújula y el efecto de piedras magnéticas. Tomó 43 valores de declinación, medidos con dos métodos introducidos por Pedro Nunes en Évora en 1533. En 1537, el portugués Pedro Nunes publica su Tratado de la esfera y Jõao de Castro publica entre 1538 y 1541 Los tres roteiros. Jõao de Castro continuó el registro de datos magnéticos en otro viaje realizado a la India con 6 barcos, en 1545. Otros datos similares se encuentran en el libro Breve compendio de la sphera y de la arte de navegar de Martín Cortés, que publicó Antón Álvarez en Sevilla en 1551.
Pedro de Medina publicó también en Valladolid en el año de 1545 una obra titulada El arte de navegar, y en 1563 Simón Carpinteiro le publica en Sevilla Regimento de navegación. En todas estas obras se discute el uso de la brújula, llamada también aguja de marear.
Felipe Guillén, boticario de Sevilla, presentó una brújula de variación al rey Jõao de Portugal.
George Hartmann, vicario de San Sebaldus, en Nuremberg, en carta dirigida al duque Alberto de Prusia el 4 de marzo de 1544, anuncia el descubrimiento de la inclinación y la declinación magnéticas. Aunque sus datos son puramente cualitativos y muy imprecisos.
Robert Norman, fabricante de instrumentos náuticos, hizo mediciones en la ciudad de Londres en 1576 para determinar la inclinación magnética con un valor de 71 grados y 50 minutos. En 1581 publicó un trabajo en The New Attractive de Londres donde describe sus experiencias al colocar una aguja imantada para girar en un plano vertical, pudiendo observar la inclinación de la aguja hacia abajo y hacia el Norte.

En el Archivo General de Indias se conservan expedientes del año 1584 sobre descubrimientos técnicos en navegación. Andrés García de Céspedes, cosmógrafo mayor de las Indias Occidentales, Juan Aricos de Loyola, Luis de Fonseca, Juan Martínez y Lorenzo Ferrer presentan estudios sobre la aguja de marear. Domingo de Villarroel, presbítero cosmógrafo del reino de Nápoles, trae a la Universidad de Mareantes de Sevilla una "nueva invención de un reloj de sol en el que puesta la brújula o aguja de marear, promete que por él se podrá saber lo que nordestea o norostea dicha aguja, lo cual sabido con la precisión que él dice, que es de 24 en 24 horas, se podrán hacer las carreras de Italia e Indias y otras partes sin rodeos...", "los regimientos y artes de marear que hasta ahora han tratado de esta cuenta y materia, para saber lo que el aguja nordestea o norostea usaban de ponerla en lugar descubierto cuando la estrella del Norte se pudiese ver, estando derechamente nordeste u dueste, y si entonces la flor de la rosa miraba derechamente a la estrella, decían que la aguja no tenía variación..."
Rodrigo de Zamorano, catedrático de cosmografía de Sevilla, presentó, en 1584, el Compendio de la arte de navegar simultáneamente con un reloj en el cual al salir y ponerse el Sol podía saberse con precisión de la aguja de marear.
Juan Jaime y Francisco Gali proyectaron en México para 1585, en tiempos del virrey-arzobispo Pedro Moya de Contreras, un viaje desde Manila hasta Acapulco con el único objeto de medir la declinación de la brújula mediante un instrumento construido por Juan Jaime.
En México, el primer libro impreso que habla de la brújula y de sus aplicaciones a la navegación es el libro de Diego García de Palacio Instrucción náutica para navegar, publicado en la ciudad de México en 1587 por Pedro Ocharte, yerno de Juan Pablos. García de Palacio fue en México rector de la Real Universidad, oidor de la Audiencia e inquisidor. El libro de García de Palacio se reeditó en edición facsimilar en 1944 en Madrid por las Ediciones de Cultura Hispánica, Colección de Incunables Americanos.
José de Acosta en su Historia natural y moral de las Indias publicada el año 1588, reconoció en la Tierra cuatro líneas sin declinación.
Simon Stevinus, matemático holandés, publica en 1599 el libro Portium investigandorum ratio, donde discute el valor de la declinación magnética para navegación.
En 1600 publicó W. Gilbert su libro De magnete, donde describe sus propias experiencias y los conocimientos de su época sobre el magnetismo. Realizó experimentos con pequeñas agujas imantadas en la vecindad de cuerpos magnéticos para conocer la dirección de las líneas del campo a lo largo de las cuales se orientaban estas agujas si se las sujetaba de un punto y se les permitía girar libremente alrededor de ese punto fijo.
Desde 1635, Gellibrand demostró el movimiento muy lento de la dirección del Norte magnético. Los archivos en Londres registran un cambio en la declinación de 11 grados al Este, hasta 24 grados al Oeste entre 1580 y 1800, posteriormente la aguja regresó en dirección al Este, y en 1900 tenía una declinación de 10 grados al Oeste. Por otra parte, la inclinación se redujo de 74.5 grados en 1700, a 71 grados en 1800, hasta su valor actual de 66 grados. La intensidad del cambio ha disminuido en un vigésimo de su valor en los últimos cien años.
E. Halley recorrió el Océano Atlántico durante dos años y publicó sus observaciones en un mapa magnético del océano en 1701. En 1702 publicó una carta magnética mundial donde recopiló la información de la variación de la brújula registrada por muchos navegantes de su tiempo. Posteriormente se han podido trazar mapas magnéticos que remontan la información hasta 1550.
La declinación en cualquier lugar de la Tierra no es constante porque está sujeta a variaciones regulares e irregulares. Las primeras son seculares, anuales o diurnas; las segundas no tienen un periodo conocido, y se han designado como perturbaciones.
En las seculares la declinación oscila con el tiempo al Este y Oeste del meridiano astronómico. Las anuales fueron observadas por César-François Cassini (1714-1784) en París, en 1784, quien reportó una retrogradación de la declinación magnética durante el equinoccio de primavera. Las diurnas son mucho más débiles.
Graham, un relojero inglés, observó en 1722 las variaciones regulares ocurridas cotidianamente y las perturbaciones mucho más grandes e irregulares que ocurren con menos frecuencia. Celsius (1701-1744), científico y astrónomo sueco, hizo observaciones similares y en 1741 estableció correspondencia con Graham encontrando que las perturbaciones magnéticas ocurrían simultáneamente en Londres y en Upsala. Ahora conocemos el carácter mundial de las perturbaciones magnéticas.
Celsius encontró también en 1741 una correlación entre las perturbaciones magnéticas y la aparición de las auroras boreales.
John Michell (1724-1793) en 1750 escribe que la fuerza de atracción o repulsión entre los polos de los imanes decrece con el cuadrado de la distancia entre ellos.
S. Poisson (1781-1840) y G. Green (1793-1841) poco después de la Independencia de México en 1825 introdujeron la idea de campo magnético como una flecha cuya dirección indica la línea del campo, la dirección donde apunta la brújula y cuyo tamaño mide la magnitud del mismo, es decir, la intensidad de la fuerza que es capaz de producir.
ELECTRICIDAD, MAGNETISMO Y LUZ
En 1785, Charles Coulomb (1736-1806), con ayuda de una balanza de torsión, establece la ley de fuerza entre cargas que lleva su nombre y encuentra también que la fuerza entre polos magnéticos varía como el inverso del cuadrado de la distancia. Esta analogía entre ambas leyes no permite asegurar que estén relacionadas.
Hasta 1819 Hans Christian Oersted (1777-1851) descubre la conexión entre los fenómenos magnéticos y los eléctricos. Observa que una corriente eléctrica produce la desviación de una aguja imantada. Este descubrimiento, asimismo, lo dio a conocer, el 3 de agosto de 1802 en Gazetta di Trentino, el juez italiano Gian Dominico Romagnosci, aunque pasó desapercibido. Al poco tiempo, Biot (1774-1862) y Savart (1791-1841) cuantifican este efecto al encontrar que la fuerza entre una corriente y un imán cercano es inversamente proporcional al cuadrado de la distancia que los separa. Ampère encuentra el mismo campo magnético producido por una corriente o por un imán. Hoy en día este resultado explica el magnetismo como el efecto superpuesto de pequeñas corrientes en cada átomo de las sustancias magnéticas. Michael Faraday (1791-1867) descubre el fenómeno de inducción al notar que mientras se conecta o desconecta una corriente eléctrica, se produce otra corriente eléctrica en un conductor vecino. El mismo efecto de producir una corriente en un circuito cerrado se observa al mover un imán cerca de ese circuito. Maxwell definió aún más este panorama al expresar en forma matemática las ideas de estos científicos y completarlas al agregar a la corriente de Ampère la corriente llamada de desplazamiento, formada por la rapidez de cambio del campo eléctrico. Era indispensable incluir esta corriente de desplazamiento para entender el comportamiento de un condensador cuando se carga y descarga por una corriente alterna.
Hay dos ideas simples que nos ayudan a entender muchos fenómenos electromagnéticos. Cuando una corriente camina por un alambre conductor se crea un campo magnético en su vecindad, que es tangente a un círculo perpendicular al alambre que pasa por su centro. El tamaño del campo magnético es inversamente proporcional a la distancia del campo al alambre. La otra idea es la siguiente. Una corriente en un circuito, o un conjunto de cargas dando vueltas en un círculo son equivalentes en sus propiedades magnéticas a un imán cuyo momento dipolar, o sea la línea que une sus polos Norte y Sur, es perpendicular al plano donde circulan las cargas.
Una de las conclusiones asombrosas de los estudios de Maxwell fue la interpretación de la luz como un fenómeno ondulatorio del campo electromagnético. Lo que vibra y se ondula en la luz es tanto el campo eléctrico como el magnético. La intensidad luminosa está formada por la superposición del campo y es proporcional al cuadrado del campo. Los campos eléctrico y magnético viajan con la velocidad de la luz porque son la luz.
No faltó en ese momento de grandes descubrimientos de la ciencia una mente pragmática que cuestionara la utilidad de dichos estudios. Esta persona no recibió una respuesta satisfactoria en seguida. Hoy, cualquier niño nos podría mostrar muchos de los inventos asombrosos que son consecuencia de aquellos estudios. Por otra parte, mentes pragmáticas han ido encontrando tantas aplicaciones que ya no se cuestiona la utilidad del electromagnetismo, ni, en los países desarrollados, la utilidad de la ciencia.
El gran matemático Carl Friedrich Gauss (1777-1855) dejó una aportación importante en la historia del electromagnetismo. Principió en 1831, al llegar el físico Wilhelm Weber (1804-1891) a trabajar con él en Gotinga, Alemania. Ambos desarrollaron los aspectos teóricos y empíricos del magnetismo. Fueron inventores de un magnetómetro para poder cuantificar el campo magnético, y en particular se interesaron en medir el campo de la Tierra. Fueron los primeros organizadores de una red internacional de observadores de las variaciones del campo magnético de la Tierra, cuyos puntos estaban distribuidos por toda Europa. En 1840 publicaron ambos un Atlas del magnetismo terrestre, el cual fue uno de los varios resultados de la cooperación internacional organizada por ellos.
La contribución de Gauss y Weber está reconocida en la unidad de campo magnético que lleva el nombre de gauss, y la unidad de flujo magnético (promedio del campo magnético total multiplicado por el área de la superficie que atraviesa el campo), que lleva el nombre de weber.
Las primeras aplicaciones de la electricidad fueron por los mismos científicos. En 1837, M. H. Jacobi (1801-1874) descubre la galvanoplastia, que le es útil para la separación de una sal metálica; al pasar una corriente eléctrica a través de una solución de sal metálica, se descompone la sal en iones dentro de dicha solución, y estos iones se mueven en direcciones opuestas. Estas sustancias se depositan en los polos por donde se conecta la solución con la corriente. La masa de sustancia depositada —encontró Faraday— es proporcional al tamaño de la corriente y a la duración de ésta. Otros resultados importantes en química se dedujeron de esta aplicación.
El telégrafo eléctrico se debe al inglés Wheastone (1802-1875), al alemán Steinheil (1801-1870) y al norteamericano Morse (1791-1872). Este último descubre su telégrafo en la Universidad de Nueva York y lo usa para conectar Nueva York y Baltimore en 1844. Estos resultados definitivos en la historia eléctrica del telégrafo fueron precedidos por Gauss y Weber, quienes en 1827 transmitieron un impulso eléctrico sobre una distancia de 300 metros. Después de varios diseños, en 1832 los palacios de verano y de invierno del zar se conectaron con un telégrafo. En 1833 Gauss y Weber hicieron funcionar un telégrafo entre dos extremos de Gotinga cubriendo una distancia de 2.3 kilómetros. Se utilizó como alfabeto cinco deflecciones de la aguja magnética a derecha o izquierda, lo cual creó 32 posibilidades diferentes (32 es el producto de elevar el número dos a la quinta potencia). La patente de Morse se inscribió siete años después.
La bobina de inducción es el ancestro de los actuales transformadores; fue descubierta por los franceses Bréguet y Masson y perfeccionada por el alemán Ruhmkorff.
Sus ecuaciones matemáticas condujeron a Maxwell (1831-1879) a la incorporación de la luz y de otras radiaciones como campos eléctrico y magnético capaces de mover cargas. A partir de ese momento los fenómenos luminosos y otras radiaciones se pudieron producir y alterar por aparatos electromagnéticos. Cada partícula cargada del mundo real se puede contemplar desde entonces como un aparato electromagnético productor de campos eléctricos y magnéticos que afectan la vecindad de la carga. A su vez, esta carga se perturba por los campos eléctrico y magnético producidos fuera de ella.
Al poco tiempo descubre Marconi el radio y de ahí provienen otros descubrimientos útiles e interesantes. La multiplicación de las aplicaciones nos parece hoy que no tendrá fin ni reposo.
Para el propósito de este libro es fundamental resumir los conocimientos de electromagnetismo recordando que los campos eléctrico y magnético se influyen mutuamente. Los cambios en el tiempo de uno de estos campos provocan torbellinos en el otro. Los campos, a su vez, producen fuerzas en cargas y magnetos. Las cargas sienten fuerzas proporcionales a su tamaño, una fuerza eléctrica en la dirección del campo eléctrico y una fuerza magnética perpendicular al campo magnético. Los magnetos sienten fuerzas como si fueran corrientes de carga dando vueltas en círculo; de hecho las sustancias magnéticas se explican con ayuda de muchas cargas que giran de manera organizada tratando de que todas las trayectorias circulares sean paralelas. Al mismo tiempo, las cargas crean un campo eléctrico en la dirección de la carga y las corrientes crean campos magnéticos perpendiculares a la corriente, tangentes a círculos imaginarios con centro en la carga que se mueve. Las cargas sienten fuerzas eléctricas y magnéticas y crean simultáneamente el mismo tipo de fuerzas.
Por muy interesante que sea el poder disponer de cargas que se trasladan por nuestra red eléctrica, dichas cargas están casi siempre ligadas a un metal y sólo raramente vuelan en el espacio sin estar sujetas a caminar por la banda de conducción de los metales.
La banda de conducción de los metales está formada por el conjunto de los electrones con la energía y cantidad de movimiento apropiadas para viajar fácilmente de un átomo al otro en el interior de un metal. No todos los electrones tienen esa libertad y no todos pueden participar en una corriente eléctrica.
Por este motivo encontramos en la naturaleza muchas sustancias provistas de un número muy elevado de electrones, los cuales están sin embargo atrapados por fuerzas de Coulomb que les impiden moverse libremente de modo que puedan producir una corriente eléctrica, hasta no encontrar una fuerza más grande que la fuerza de Coulomb o una energía capaz de vencer el trabajo de mover esta carga de su lugar.
Incluso en un metal que tenga muchos electrones en la banda de conducción, hay también muchos otros electrones atrapados por fuerzas de Coulomb, sin poder seguir a sus compañeros en la corriente que les permita trasladarse a distancias de muchos kilómetros.
Nuestro interés consiste aquí en la manera de atrapar las cargas plenas de energía tal y como se encuentra libremente en el Sol. Las queremos atrapar en la Tierra sin que destruyan el recipiente contenedor fundiéndolo por su enorme temperatura. El metal no es entonces un buen contenedor, pero podemos hacer una botella magnética capaz de capturar a las cargas sin bajar su gran temperatura. Las líneas magnéticas del recipiente se forman haciendo circular corrientes en enormes bobinas mantenidas a muy bajas temperaturas a fin de mejorar la conducción eléctrica en ellas. Dichas bobinas no se destruyen con las cargas de alta temperatura puesto que no están en contacto con ellas. Las corrientes hacen el campo fuera de ellas, y el campo atrapa a las cargas y las conserva en su prisión hasta que se funden unas con otras y rinden entonces una enorme producción de potencia.
EL ESCRUTINIO DE LA ESTRUCTURA DEL ÁTOMO
Dejemos en paz la idea de las cargas dentro de los metales en su movimiento de rápidas corrientes, y volvamos de nuevo a los protones y electrones dentro de los átomos, formando ahora una estructura en equilibrio de fuerzas entre cargas positivas y negativas mediante la fuerza atractiva de Coulomb entre cargas de distinto signo y venciendo la fuerza repulsiva entre protones, con ayuda de la fuerza nuclear entre protones y neutrones. Esta fuerza nuclear triunfa sobre la fuerza de Coulomb a pequeñas distancias, y sin embargo será derrotada por la fuerza de Coulomb a distancias más grandes que el tamaño de los protones y neutrones que forman, en el núcleo, un cúmulo de partículas.
En el año de 1854, H. Geissler (l8l5-1879) inventó el tubo de rayos catódicos casi al vacío; este tubo, de vidrio, tiene conectados dos electrodos por medio de alambres con el exterior, los cuales se conectan a una fuente de corriente. De este modo establece un viento de electrones del cátodo al ánodo a una enorme velocidad que se eleva hasta un décimo de la velocidad de la luz. Las experiencias en este tubo permitieron descubrir a J. J. Thomson (1856-1940) que la carga eléctrica se da en pequeñas partículas, todas parecidas. Thomson pudo así determinar la relación entre la carga eléctrica y el peso de las partículas que forman los rayos del tubo catódico, mediante la medición de la fuerza magnética necesaria para desviar el chorro de partículas cargadas. Se demostró así que la relación carga/peso de estas partículas es casi 2 000 veces más alta que la relación carga/peso en el núcleo del átomo de hidrógeno. Las partículas de los rayos del tubo catódico son los electrones, y los núcleos del átomo de hidrógeno son los protones.
El número de protones en el núcleo nos dice de qué sustancia química se trata. Los átomos de un elemento químico tienen todos la propiedad de tener en su núcleo el mismo número de protones, y esto garantiza las mismas propiedades químicas. Los átomos de un elemento químico, al tener todos el mismo número de protones, se parecen todos entre sí. El número de neutrones en cada átomo debe ser el suficiente para mantener al núcleo perfectamente unido por medio de fuerza nuclear. Cuando el núcleo del átomo de un elemento químico tiene pocos protones, el número de neutrones es igual o menor al número de neutrones para mantener unido al núcleo. Conforme el átomo posee más protones, requiere mayor número de neutrones para mantener unido al núcleo.
El número de neutrones contenidos en un núcleo puede variar un poco. Para distinguir a los átomos del mismo elemento químico, con igual número de protones pero distinto número de neutrones, se habla de isótopos del elemento químico con un número igual de protones en el núcleo. Por ejemplo, cuando nos referimos al carbono 14 estamos pensando en la sustancia carbono cuyos átomos tienen todos un núcleo con 6 protones —como todos los átomos de carbono— pero con 8 neutrones, para formar en total 14 partículas en el núcleo de cada átomo de carbono 14. El carbono 14 es muy conocido porque se utiliza para establecer la edad de los objetos que lo contienen. El carbono con mayor abundancia en la naturaleza es el carbono 12 con 6 protones y 6 neutrones. Existen 13 isótopos diferentes conocidos del carbono.
En 1913, Frederick Soddy (1877-1956), presentó como conclusión de numerosos estudios la existencia de la misma sustancia química con diferentes pesos de sus moléculas. Se llamaron isótopos por ocupar el mismo sitio en la tabla periódica de los elementos. El número de protones determina las propiedades químicas, por lo que los átomos de diferentes isótopos del mismo elemento tienen el mismo número de protones. En la misma fecha y Convención Química en Birmingham, presentó F. W. Aston (1877-1945) la descripción del experimento en que determina, mediante la deflección de átomos ionizados de neón, la existencia de dos tipos diferentes de pesos atómicos iguales a 20 y 22, en la unidad de peso del protón. El experimento de Aston usó la técnica de Thomson con campos magnéticos y fue otra demostración de la existencia de los isótopos.
Cuando el núcleo de un isótopo inestable se descompone en otras partículas, la masa de las partículas resultante no es idéntica a la masa original del núcleo descompuesto. Esta diferencia de masa fue detectada también por F. W. Aston en 1927 mediante la invención del espectrógrafo de masas. Veremos después cómo esta pequeña diferencia de masas constituye el origen de la gran emisión o absorción de energía en otros procesos.
Veamos ahora el experimento de Faraday-Helmholtz a fin de medir con precisión el valor de la carga del electrón por medio de la electrólisis. Se toma por ejemplo una solución en agua de sulfato de zinc y se sumergen en ella dos placas, una de cobre y otra de zinc, que se conectan con alambres a una batería eléctrica. La corriente eléctrica atraviesa la solución y provoca la disolución de las dos placas de metal. La proporción de peso perdido de cobre y de zinc es igual a la proporción entre sus pesos atómicos 63.546/65.38. Los pesos atómicos miden la cantidad de neutrones y protones en el átomo y se dan en gramos. El peso atómico del cobre natural es aproximadamente 63.546. Este número es consecuencia de tener los isótopos 63 y 65, ambos estables, en una mezcla en la proporción adecuada para dar ese número. El peso atómico del zinc es 65.38, mezcla a su vez de los cinco isótopos estables del zinc 64, 66, 67, 68 y 70. Se ha medido el número de átomos cuyo peso es el peso atómico de un material. Éste es el número de Avogadro, igual a 6.022045 x 1023 esto es, aproximadamente el enorme número formado por un 6 seguido de 23 ceros. La carga eléctrica que atravesó la solución se mide fácilmente, y el cociente de esta carga entre el número de átomos disueltos es igual a la carga del electrón.
Si la electrólisis fue el fundamento del desarrollo tecnológico de la galvanoplastia, las mediciones precisas de masa, corriente y carga mencionada en el párrafo anterior permitieron penetrar al mundo microscópico de la estructura de la materia y descubrir algunos secretos de su estructura y de sus propiedades.
Los isótopos de un elemento pueden ser estables o inestables en el tiempo. Los isótopos inestables son radiactivos. El descubrimiento de las sustancias radiactivas en 1896 se debe a Henri Becquerel (1852-1908), como consecuencia de sus estudios sobre fluorescencia estimulada por rayos X, durante los cuales encontró la emisión radiactiva no estimulada en el uranio. Pierre Curie (1859-1906) y Marie Sklovdovska (1867-1934 ) encontraron otros dos elementos radiactivos, el polonio y el radio. Becquerel y los esposos Curie recibieron por esto el premio Nobel. Los núcleos de los isótopos radiactivos emiten cargas positivas en la forma de núcleos de helio, llamados también partículas alfa. Emiten electrones formando la radiación llamada beta. Y asimismo emiten radiación electromagnética de muy alta frecuencia llamada radiación gamma, con algunas propiedades de partículas que entonces son llamadas fotones. En algunas ocasiones pueden emitir electrones positivos, llamados positrones. Como consecuencia de la emisión de electrones pueden emitir también neutrones.
En ciertos casos se encuentran también los procesos inversos de los anteriores, como cuando un núcleo captura un electrón.
Todos estos procesos ocurren con conservación de la suma total de carga, tanto positiva como negativa. También se conserva el número total de nucleones, protones y neutrones. La masa puede no conservarse porque se convierte en energía. Una pequeña cantidad de masa que desaparece se convierte en una gran cantidad de energía de acuerdo a la fórmula de Einstein: la cantidad de energía producida es igual al producto de la masa por el cuadrado de la velocidad de la luz.
El número de isótopos de un elemento puede ser variable y varios de éstos pueden ser estables o radiactivos. El estaño se distingue por ser el elemento con más isótopos, 34 radiactivos y 10 estables, 44 isótopos en total. El xenón, el antimonio y el mercurio tienen cerca de 40 isótopos cada uno de ellos, pero mientras que el xenón tiene 9 isótopos estables, el mercurio tiene 7 y el antimonio sólo 2. Los isótopos del hidrógeno son 3, llamándose hidrógeno al que tiene como núcleo un protón, y deuterio al que tiene un protón y un neutrón en el núcleo; por último, se le llama tritio al isótopo del hidrógeno con un protón y dos neutrones; el tritio es radiactivo. El helio tiene 7 isótopos —de los cuales los más conocidos son el helio 3, con dos protones y un neutrón y el helio 4, con dos protones y dos neutrones— que cuando carecen de los dos electrones que le dan neutralidad se llaman partículas alfa, como vimos arriba. Estos dos isótopos del helio son estables. Pero hay que advertir que estos números son relativos. Conforme pasa el tiempo se obtienen nuevos isótopos radiactivos en forma artificial, por lo cual estos valores crecerán en el futuro.
Al aumentar el número de neutrones para formar nuevos isótopos éstos se vuelven más inestables, duran tiempos pequeñísimos y resulta una proeza por parte de la ciencia y de la técnica el poderlos observar.
Los núcleos de los isótopos radiactivos tienen la propiedad de poderse modificar mediante diversos procesos, algunos de ellos espontáneos. La historia de los procesos radiactivos en un elemento químico se puede estudiar en un mineral donde se encuentre dicho elemento. En dicho mineral pueden concentrarse todos los productos en los cuales es posible transformar radiactivamente dicho elemento, formando la familia de aquellos en que puede convertirse espontáneamente.
Como fenómeno radiactivo importante se encuentra primero la emisión de partículas alfa, formadas por núcleos de helio. Un núcleo, al emitir una partícula alfa, pierde con ella dos protones de carga positiva y dos neutrones. La pérdida de dos protones cambia las propiedades químicas del núcleo; con ello se tiene la transmutación de los elementos, el sueño anhelado de los alquimistas. La masa de los productos del núcleo no es igual a la que tenía antes de escindirse, y esta diferencia de masa se transforma en energía en relaciones asombrosas pues, por un gramo de masa desaparecida, se obtiene un equivalente en energía que disfruta de la generosa fórmula de Einstein (1879-1955), E=mc2, suficiente para subir por una escalera diez mil toneladas una distancia cercana a un metro.
Otro tipo de proceso radiactivo es la emisión de electrones positivos o negativos. Como estas partículas no existen en el núcleo, deben fabricarse a partir de la energía o masa del núcleo. Afortunadamente un electrón tiene una masa varios miles de veces menor que la masa del núcleo donde se forma. Al lanzar al exterior un electrón positivo, el núcleo pierde una carga positiva y sus propiedades químicas cambian debido a que el núcleo tiene entonces un protón menos y un neutrón más. Al lanzar un electrón negativo sucede lo contrario, el núcleo gana ahora un protón y pierde un neutrón. Ambas emisiones se denominan radiaciones beta, las cuales pueden ser positivas o negativas según la carga de los electrones.
Acompañando al proceso de emisión de electrones, un núcleo puede perder también un neutrón. En este caso no se modifican las propiedades químicas del núcleo por no alterarse el número de protones al expulsar un neutrón. Éste es un proceso secundario pero con todas las características de otras radiaciones.
De cierta importancia es el proceso de captura de electrones en el núcleo. Este proceso ocurre en sentido inverso al de emisión de electrones, y se produce con todos los efectos en sentido contrario.
Estos procesos vienen acompañados por radiaciones electromagnéticas de alta frecuencia conocidas como radiación gamma. Esta radiación encuentra siempre su explicación en el balance de masa y energía, y es la fuente de la aplicación de la ciencia nuclear a la industria energética.
De manera artificial puede provocarse también que el núcleo se rompa o se fisione como consecuencia de una colisión. En esta ruptura dos cúmulos de carga positiva se separan lo suficiente para que domine la fuerza de Coulomb sobre la fuerza nuclear y ambos pedazos se repelen violentamente. En esta fisión pueden originarse las radiaciones alfa, beta y gamma, y pueden producirse muchos otros tipos que incluyen, como caso particular importante, la posible emisión de neutrones.
Cuando el número de protones y neutrones de un núcleo es elevado, la ruptura del núcleo produce energía electromagnética en la forma de rayos gamma. Pero, cuando el número de nucleones es reducido, sucede lo contrario: al unirse los núcleos se obtiene energía. Esto hace la diferencia entre los procesos de fusión y fisión para utilizar la energía sobrante de las reacciones nucleares.
Se dice entonces que ha ocurrido una reacción nuclear. Las reacciones nucleares pueden ser procesos violentísimos que al ocurrir hacen desaparecer una cierta cantidad de masa que se convierte en la energía responsable del nacimiento de los fotones de la radiación gamma, de la energía necesaria para crear los electrones y de la energía en movimiento con la cual salen volando todos los productos de la reacción.
Los cuerpos radiactivos emiten cargas positivas y negativas capaces de identificarse mediante varios experimentos. Se distinguen de las corrientes en conductores porque vuelan libremente en el espacio. Aun así, se comportan de manera análoga a las cargas de los metales porque responden con las mismas aceleraciones a las fuerzas electromagnéticas.
Las cargas emitidas por los cuerpos radiactivos pueden usarse como fuentes de carga para bombardear blancos y descubrir lo que sucede ante un haz de carga. E. Rutherford, en 1910, envió un haz de partículas alfa sobre hojas delgadas de metal. Las partículas que se desvían de su dirección original se dice que son dispersadas por las hojas de metal, desviación medida a través del conteo de los destellos producidos en una pantalla de sulfuro de zinc. Para explicar los resultados experimentales se concluyó la existencia de un pequeño núcleo de carga positiva en el centro del átomo. Las predicciones teóricas y experimentales fueron acordes después de una amplia discusión. Se pudo predecir la densidad de cargas dispersadas para cada ángulo, y se comparó esta predicción con las mediciones precisas de Geiger y Marsden en 1913; ambos cambiaron la energía de los proyectiles alfa, el grosor de las hojas de metal, el tipo de metal, el ángulo entre el haz incidente y la pantalla de sulfuro de zinc, etc. El acuerdo fue excelente y el progreso de la ciencia no ha perturbado dicho desenlace.
No hay comentarios:
Publicar un comentario